ТЕМА 1. БУДОВА АТОМА. ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ
| Назад до Завд. 3 | Завд. 4 | Вперед до Завд. 5 |
Завдання для засвоєння матеріалу 4
Схарактеризуйте хімічні елементи Берилій, Оксиген, Натрій та Фосфор за планом, наведеним у цьому параграфі (табл. 5).
| Берилій | Оксиген |
|
Порядковий номер 4, 2-ий період, |
Порядковий номер 8, 2-ий період,VI група, головна підгрупа |
|
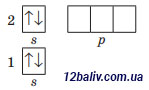
Заряд ядра +4, містить 4 протони, 5 нейтронів (9-4=5), 4 електрони. Електронна оболонка складається з 2 енергетичних рівнів. На зовнішньому рівні міститься одна електронна пара. Будова зовніш- нього електронного рівня:
Електронна формула: 1s22s2 |
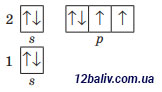
Заряд ядра +8, містить 8 протонів, 8 нейтронів (16-8=8), 8 електронів. Електронна оболонка складається з 2 енергетичних рівнів. На зовнішньому рівні міститься дві електронні пари і 2 неспарені електрони. Будова зовнішнього електронного рівня:
|
|
s-елемент, металічний, для набуття електронної конфі- гурації найближчого інертного елемента втрачає 2 електрони |
р-елемент, неталічний, до завершення електронного рівня приймає 2 електрони
|
| Ar(Be)=9 | Ar(O)=16 |
|
Вища валентність ІІ, формула вищого оксиду ВеО |
Вища валентність: ІІ ― |
|
Ве(ОН)2, основа |
― |
|
Леткої сполуки з Гідрогеном не утворює |
Н2О
|
|
Металічні властивості виражені сильніше, ніж у Бору, але слабше ніж у Літію і Магнію |
Неметалічні властивості виражені сильніше, ніж у Нітрогену і Суль- фуру, але слабше, ніж у Флуору |
| Натрій | Фосфор |
|
Порядковий номер 11, 3-ий період, |
Порядковий номер 15, 3-ий період, |
|
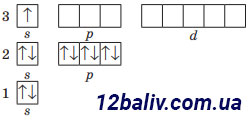
Заряд ядра +11, містить 11 протонів, 12 нейтронів (23-11=12), 11 електронів. Електронна оболонка складається з трьох енергетичних рівнів. На зовнішньому рівні міститься один неспарений електрон. Будова зовнішнього електронного рівня:
Електронна формула: 1s22s22р63s1 |
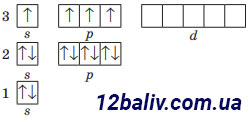
Заряд ядра +15, містить 15 протонів, 16 нейтронів (31-15=16), 15 електронів. Електронна оболонка складається з трьох енергетичних рівнів. На зовнішньому рівні міститься одна електронна пара і три неспарені електрони. Будова зовнішнього електронного рівня:
Електронна формула: 1s22s22р63s23p3 |
|
s-елемент, металічний, для набуття електронної конфігурації найближчого інертного елемента втрачає 1 електрон |
р-елемент, неталічний, до завершення електронного рівня приймає 3 електрони
|
| Ar(Na)=23 | Ar(P)=31 |
|
Вища валентність І, формула вищого оксиду Na2О |
Вища валентність V, формула вищого оксиду P2О5 |
|
Формула гідрату вищого оксиду NaОН, основа (луг) |
Формула гідрату вищого оксиду H3PO4, кислота |
|
леткої сполуки з Гідргеном не утворює |
РН3
|
|
Металічні властивості виражені сильніше, ніж у Магнію і Літію, але слабше ніж Калію
|
Неметалічні властивості виражені сильніше, ніж у Силіцію і Арсену, але слабше, ніж у Сульфуру і Нітрогену |